İNDİR
ELEMENTLERİN SINIFLANDIRILMASININ TARİHSEL GELİŞİMİ
Elementlerin Sınıflandırılması Özet 2


Dimitri Mendeleyev sıralamayı artan atom ağırlıklarına göre yapmıştır. Bu sıralama günümüzde kullanılan sıralamaya yakın bir sıralamadır.
Elementler ve elementlerle ilgili bilgiler içeren tabloya periyodik tablo(sistem/çizelge) denir.
Günümüzde kullanılan modern periyodik sistemin temeli protonun keşfi ile olmuştur. Henry Moseley ise elementleri artan proton sayılarına (atom numaralarına) göre düzenleyerek günümüzdeki periyodik tablonun temelini oluşturmuştur.
Glenn Seaborg ise periyodik tablonun altına iki sıra daha ekleyerek tabloya son halini vermiştir.
Periyodik tablodaki yatay sıralara periyot denir ve periyodik tabloda 7 tane periyot vardır.
Periyodik tablodaki dikey sıralara ise grup denir ve 8 tane A, 10 tane B olmak üzere toplam 18 tane grup vardır.
Periyodik tablodaki elementlerin özellikleri dikkate alındığında elementler metal,ametal ve yarımetal olarak sınıflandırılır.
1-METALLER
- Periyodik tablonun sol tarafında bulunur.
- Civa hariç hepsi oda sıcaklığında katı haldedir.(Civa sıvıdır.)
- Parlaktır ve ışığı yansıtırlar.(Örnek:Au,Cu vb…)
- Tel ve levha haline getirilebilir, yani işlenerek şekil verilebilir,kırılgan değildir. (Örnek:Au,Cu,Ag,Al vb…)
- Elektriği ve ısıyı iyi iletir. (Örnek:Au,Cu,Ag vb…)
- Birbirleriyle bileşik yapmazlar.
- Ametallerle bileşik yaparlar.
- Birbirleri ile alaşım yaparlar.Örnek: Çelik(demir ve karbon), pirinç(bakır ve çinko), tunç(bakır ve kalay), lehim(kalay ve kurşun)
- Bileşik yaparken daima elektron vererek “+” yüklü katyon olurlar.
2-AMETALLER
- Hidrojen hariç periyodik tablonun sağ tarafında bulunurlar.
- Oda koşullarında katı(C,P,S,I), sıvı (Br) ve gaz (H,He,N,Cl,O) halinde bulunur.
- Genelde mattırlar.
- Tel ve levha haline getirilemezler, kırılgandırlar.
- Elektriği ve ısıyı iyi iletmezler.
- Hem birbirleriyle hem de metallerle bileşik yaparlar.
- Bileşik yaparken elektron alarak “-“ yüklü anyon olma eğilimindedirler.
3-YARI METALLER
- Fiziksel özellik bakımından metallere, kimyasal özellik bakımından ametallere benzerler.
- Oda sıcaklığında katı haldedir.
- Parlak veya mat olabilir.
- Tel ve levha haline getirilebilir, yani işlenerek şekil verilebilir, kırılgan değildir.
- Elektrik ve ısıyı ametallerden daha iyi, metallerden daha az iletir.
- Sıcaklık yükseldikçe iletkenlik artar.
- Bor,Silisyum ve Germanyum örnek olarak verilebilir.
NOT: Periyodik tabloda bazı grupların özel isimleri vardır.
1A Alkali metal
2A Toprak alkali metal
7A Halojenler
8A Asal gazlar(soygazlar)
KİMYASAL TEPKİMELER
Maddelerin kimyasal değişeme uğrayarak yeni maddelerin oluşması sürecine kimyasal tepkime denir. Canlılarda büyüme, solunum, sindirim, fotosentez gibi olaylar kimyasal tepkime sonucunda gerçekleşir.
Kimyasal tepkimede molekülleri ve moleküllerdeki atomları bir arada tutan bağlar kopar ve yeni bağlar oluşur.
- Renk değişimi, gaz çıkışı,çökelti oluşumu,ısı ve ışık yayılması gibi olaylar kimyasal değişim/tepkime olduğunu gösteren ipuçlarıdır.
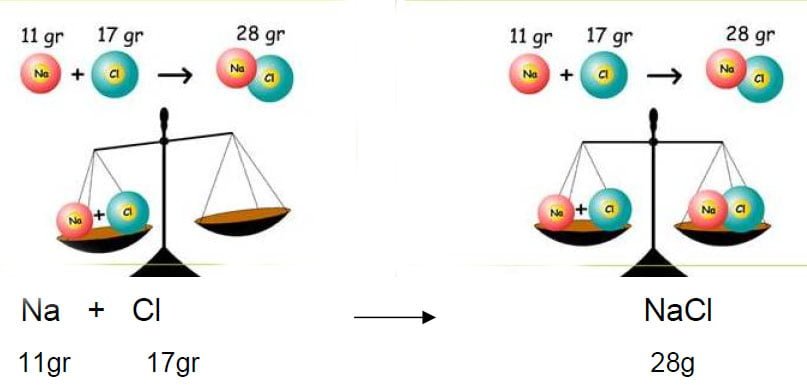
KÜTLENİN KORUNUMU KANUNU
Kimyasal tepkimelerde maddelerin toplam kütlesi azalmaz ya da artmaz. Yalnızca maddeleri oluşturan atomlar yer değiştirir ve atomlar farklı bir düzene girerek madde bir başka maddeye veya maddelere dönüşür.
Kimyasal tepkimelerde atomlar yok olmadığı ve yeni atomlar oluşmadığı için tepkimeden sonra yeni madde oluştuğunda kütlede herhangi bir değişiklik olmaz. Başka bir ifade ile kimyasal tepkimelerde, tepkimeye giren madde miktarı ve tepkime sonucu oluşan madde miktarı birbirine eşittir. Dolayısı ile kütle korunur.
KİMYASAL TEPKİMELERİN DENKLEŞTİRİLMESİ
- En kalabalık atoma sahip bileşiğin (C6H12O6 vb…) katsayısı 1 olarak yazılır.
- H ve O elementleri en sona bırakılır. Eğer bu iki element en sona kalmışsa da H önce eşitlenir.
- Katsayı element ya da bileşiğin en başına yazılır. ( 3H2 ve 2CO2 gibi /
C2O2şeklinde asla yazılmaz!!!!!!!) - Kesirli ifade yalnızca moleküler haldeki elementin (H2,O2,N2 gibi) başına yazılabilir. Bileşiğin başına kesirli ifade yazılmaz!!!
- Bileşiğin başına yazılan katsayı bileşikteki tüm elementleri etkiler.
- Her katsayı yazımından sonra diğer elementlerin atom sayısını tekrar kontrol et,çünkü bileşiklerde başa katsayı yazıldığından hepsinin sayısı değişir.
- Elementin sağ alt köşesindeki rakam, o elementten bileşiğin içinde kaç tane olduğunu gösterir.
Bir kimyasal tepkimede değişmeyenler;
1-Tepkimeye giren atom çeşidi ve sayısı
2-Toplam kütle
3-Toplam proton/nötron ve elektron sayısı
4-Toplam yük
YANMA TEPKİMELERİ
Kimyasal tepkimelerde maddeler oksijen gazıyla tepkimeye giriyorsa bu tür tepkimeler “yanma tepkimeleri” olarak adlandırılır.
C3H8 + 5O2 → 3CO2 + 4H2O + ISI
GİRENLER ÜRÜNLER
- Eğer bir tepkimenin girenler kısmında oksijen molekülü (O2) varsa o tepkime yanma tepkimesidir.
Şekilde metan gazının oksijen ile yanma tepkimesi modellenmiştir.
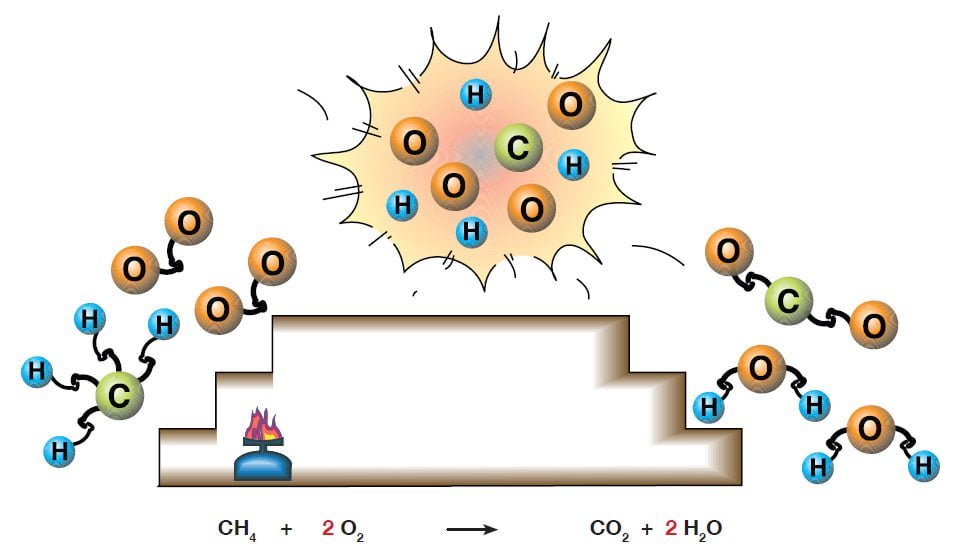
Yanma tepkimeleri alevli veya alevsiz olabilir. Sadece kömürün, odunun, kağıdın yanması yanma tepkimesi değildir.
Bazı yanma tepkimeleri çok uzun yıllar sürebilir. Örneğin, demir parmaklıkların, arabanın kaportasının paslanması bir yanma tepkimesidir. Çünkü bu metaller de havada bulunan oksijenle tepkimeye girerek yanarlar. Aynı zamanda besinlerden enerji elde edilmesi de yanma tepkimesine örnek olarak verilebilir.
Yemeklerimizin pişirilmesi, yediğimiz besinlerin vücudumuzda sindirilmesi, solunum, arabaların çalışması (araçlarda motorların çalışması), roketlerin uzaya fırlatılması için de yakıtların oksijenle tepkimeye girmesi gerekir.

Elementlerin Sınıflandırılması Özet 2
