İNDİR
MADDENİN YAPISI ve ÖZELLİKLERİ
-
MADDENİN TANECİKLİ YAPISI
Atomun Yapısı
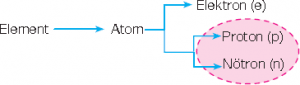
Maddenin en küçük yapıtaşına atom denir. Atomu oluşturan bu parçacıklar proton, nötron ve elektronlardır.
Nötron ve protonlar atomun merkezinde bulunur. Nötron ve protonların bulunduğu bu kısım çekirdek olarak adlandırılır.
Elektronlar ise çekirdeğin etrafında yer alır.
Atomu oluşturan parçacıklar farklı yüklere sahiptir. Farklı yüke sahip bu parçacıklar birbirini etkileyerek bir arada bulunur ve atomu oluşturur.
Protonlar pozitif, elektronlar negatif, nötronlar ise yüksüz parçacıklardır.
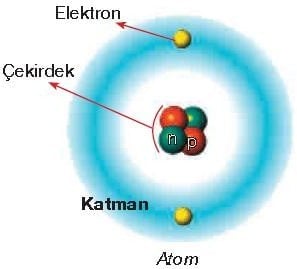
Elektronlar çekirdekten belirli uzaklıklarda hem kendi etraflarında hem de çekirdeğin etrafında çok hızlı hareket eder. Bu sebeple elektronlar çekirdeğe düşmezler, çekirdek tarafından çekildikleri için de dışarı fırlamazlar.
Atomun çekirdeğinde bulunan proton ve nötronun kütlesi hemen hemen birbirine eşittir. Elektronun kütlesi ise proton ve nötronun kütlesinden çok daha küçüktür. Protonun veya nötronun kütlesi, elektronun kütlesinin yaklaşık olarak 2000 katı kadardır. Bu durumda atomun kütlesinin yaklaşık olarak proton ve nötron kütleleri toplamıdır.
Aynı atomda bulunan elektronlar çekirdekten farklı uzaklıklarda bulunur. Elektronların ortalama olarak bulunduğu bölgeler katman olarak adlandırılır.
Atom ile İlgili Gelişmeler
Democritus: MÖ 400 lü yıllarda maddeleri oluşturan en küçük birimin atom olduğunu belirtmiştir.
John Dalton: Atom konusunda ilk bilimsel çalışmayı yapmıştır. Atomu içi dolu,
parçalanamayan, berk kürelere benzetmiştir
John Joseph Thomson: Atomu üzümlü keke benzetmiştir. Bu modelde keki pozitif yüklere, üzümleri ise negatif yüklere benzetmiş ve atomun parçalanamadığı fikrini yıkmıştır.
Ernest Rutherford: Pozitif yüklere proton, pozitif yüklerin bulunduğu kısma ise çekirdek adını verdi. Elektronların çekirdeğin çevresinde Dünya’nın Güneş çevresinde yaptığı harekete benzer olarak hareket ettiğini söyledi.(Nobel Kimya Ödülü)
Niels Bohr: Çekirdekte bulunan nötronları keşfetti. Elektronların çekirdeğe belirli uzaklıklarda bulunan katmanlarda döndüğünü belirtti. (Nobel Fizik Ödülü)
Modern Atom Teorisi: Modern atom teorisine göre elektronlar çok hızlı hareket ettikleri için sabit bir yerleri yoktur.
Elektronun bulunabileceği ve hareket ettiği kısımlar elektron bulutu olarak adlandırılır. Her bulut elektronların bulunma olasılığının en fazla olduğu bölgeyi gösterir.
Atomun kimliğini proton sayısı belirler. Bu yüzden proton sayısı aynı zamanda atomun numarasıdır.
İyonları Tanıyalım
Aynı atom için proton ve elektron sayıları eşittir. Proton ve elektron sayıları eşit olan atomlara nötr atomlar denir.
Atomlarda birden fazla sayıda katman bulunabilir ve katmanlardaki elektron sayısı farklı olabilir. Ancak ilk katmanda en fazla iki elektron bulunabilir.
İkinci ve üçüncü katmanlarda bulunabilecek elektron sayısı sekizi geçemez.
Elektronlar öncelikle çekirdeğe en yakın katmanda bulunur.
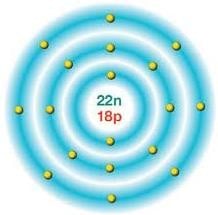
Sahip oldukları elektron dizilimini değiştirme isteği olmayan bu özellikteki elementler soy gazlar olarak adlandırılır. Bu elementlere ait atomların son katmanında yeterli sayıda elektron bulunmaktadır.
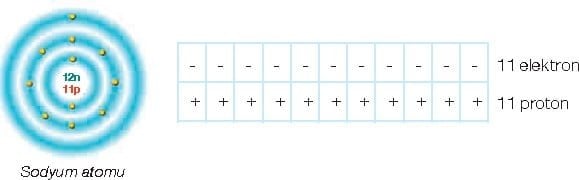
Atomların katmanlarında belirli sayılarda elektron bulunmaktadır. Ancak bir atom, tek katmanlıysa ve bu katmanda iki elektronu varsa kararlıdır. Atomun iki katmanı ya da üç katmanı varsa ve bu katmanlarda sekiz elektron bulunuyorsa bu tür atomlar kararlı yapıya sahiptir.
Sonuç olarak; atomların son katmanları tam dolu ise bu atomlar kararlı yapıya sahiptir.
Atomlar, elektron alışverişi yaparak kararlı atomların elektron dizilimine ulaşmaya çalışırlar. Atomlar, elektron alarak veya vererek kararlı atomların elektron dizilimine ulaştıklarında iyon olarak adlandırılır.

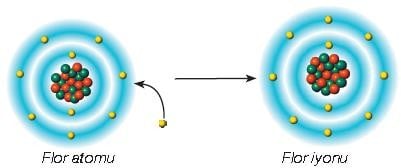

Flor iyonunda negatif yük sayısı pozitif yük sayısından fazla olduğu için bu iyon negatif yüklüdür.
Atomlar elektron aldığında negatif yükle yüklenerek iyon hâline gelirler. Negatif yüklü bu iyonlar, anyon olarak adlandırılır.
Bir iyonda negatif yük sayısı pozitif yük sayısından ne kadar fazla ise o sayı, sahip olduğu yükle birlikte atomun sembolünün sağ üst köşesine yazılır.
![]()
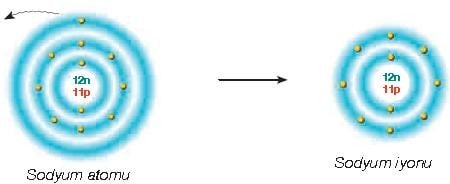
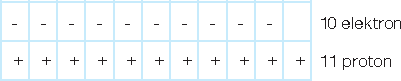
Atomlar elektron verdiğinde pozitif yükle yüklenirler. Pozitif yüklü bu iyonlar, katyon olarak adlandırılır.
Katyonlarda pozitif yük sayısının negatif yük sayısından ne kadar fazla olduğu bulunur ve fazla olan yük sayısı ise, sembolün sağ üst köşesine yazılır.
İyonlar, her zaman tek atomlu olmayabilir. Birden fazla atom gurup halinde negatif ya da pozitif yüke sahip olur. Bu atomlara çok atomlu iyon denir.
Bazı maddeler atom veya moleküllerden oluşurken bazı maddeler ise atomların
elektron alması ve vermesi sonucu oluşan iyonlardan meydana gelir. Örneğin, demir elementi atomlardan, iyot elementi moleküllerden, sodyum klorür ise iyonlardan oluşmaktadır.
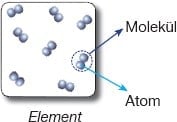
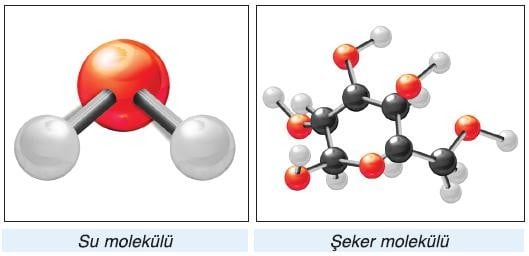
Moleküller
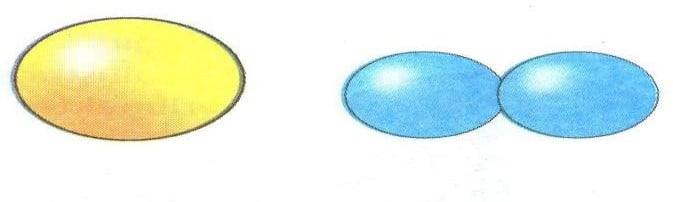
Maddeleri oluşturan atomlar, tek tek ya da gruplar halindedir. Örneğin, altının en
küçük taneciği tek bir atomdan oluşurken, oksijenin en küçük taneciği iki tane oksijen atomunun bir araya gelmesi sonucu
oluşmuştur. En küçük birim tek bir atom ise maddenin taneciği atomik yapıda, gruplar halinde ise maddenin taneciği molekül yapıdadır.
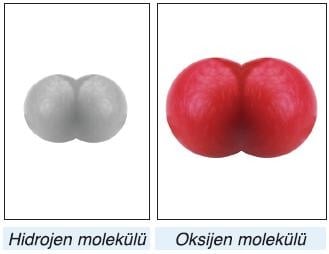
Moleküller aynı ya da farklı atomlardan oluşabilir. Molekül az sayıda atom içeriyorsa basit yapılı, çok sayıda atom içeriyorsa karmaşık yapılıdır.
SAF MADDELER
- Saf Maddeleri Tanıyalım
İçlerinde kendinden başka madde bulunmayan maddelere saf maddeler denir.

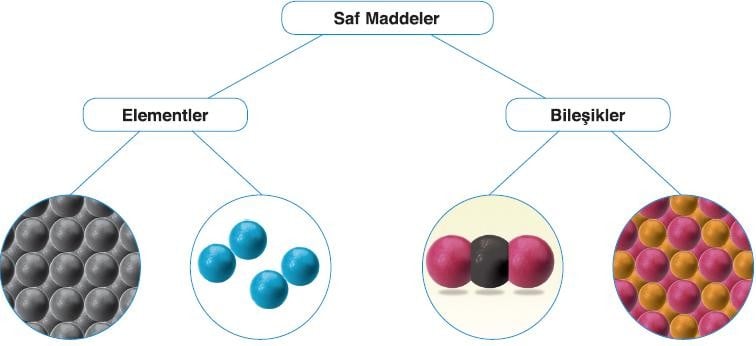




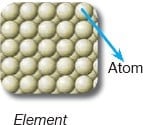
Aynı cins atomlardan oluşan saf maddelere element denir.
- Aynı elementin bütün atomları birbirleriyle aynıdır, farklı elementlerin atomları ise birbirinden farklıdır.
- Elementler fiziksel ya da kimyasal yöntemlerle kendinden daha basit maddelere ayrışamazlar.
- Atomik ya da moleküler yapıda olmak üzere ikiye ayrılırlar.
- Atomik yapılı elementleri en küçük birimi atom, molekül yapılı elementlerin en küçük birimi moleküldür.
- Sembollerle gösterilir.

Atomik Moleküler
Bakır: Mutfak eşyalarında ve elektrikli araçların iletken kısımlarında kullanılır.
Demir: Marul, pekmez gibi besinlerimizde bulunan demir inşaat malzemesi olarak kullanılır.
Çinko: Mutfak eşyalarında ve pillerde kullanılır.
Karbon: Kurşun kalemlerde bulunur.
Civa: Bazı termometrelerde ve diş dolgularında kullanılır.
İyot: Deniz ürünlerinde ve sofra tuzunda bulunur.
Krom: Metal maddelerde sertlik sağlamada ve zırhlı araç yapımında kullanıldığı gibi yer fıstığı, yumurta sarısı, peynir, üzüm suyu gibi gıda maddelerinde de bulunur.
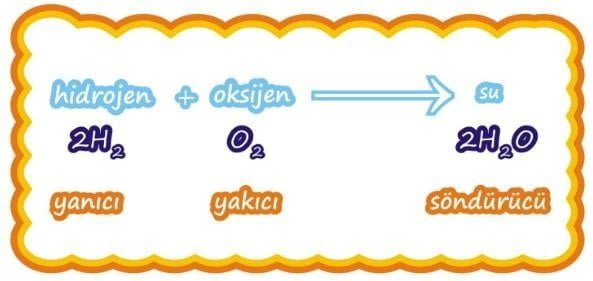
Farklı elementlere ait atomların belirli oranlarda bir araya gelerek bağ yapmasıyla oluşan yeni ve saf maddeye bileşik denir.
- En az iki farklı cins atomdan oluşurlar.
- Kendini oluşturan maddelerden tamamen farklı özelliklere sahiptirler.
- Kimyasal yöntemlerle bileşenlerine ayrılabilirler.
- İyonik ya da moleküler yapıda olmak üzere ikiye ayrılırlar.
- Formüllerle gösterilirler.
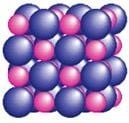
Moleküler İyonik
- Elementlerin Sembolleri
Bilimsel çalışmalar sırasında elementleri adlarıyla kullanmak iletişimi zorlaştırır, ayrıca zaman kaybına da yol açar. Bilim adamları bu yüzden, ortak bir dil sağlamak ve kısa zamanda çok şey anlatmak için çeşitli işaretlerden yararlanmışlardır.
Bilim insanları elementlerin Latince adlarının yerine bu adların ilk harflerini tercih etmişler ve bu harfler elementlerin sembolü olarak kullanılmıştır. İlk harfleri
aynı olan elementler olduğunda da element adının ilk iki harfi tercih edilmiştir. İki harfle
belirtme durumunda ilk harf büyük, ikinci harf küçük yazılmıştır.
| No | Elementin Adı | Sembol |
| 1 | Hidrojen | H |
| 2 | Helyum | He |
| 3 | Lityum | Li |
| 4 | Berilyum | Be |
| 5 | Bor | B |
| 6 | Karbon | C |
| 7 | Azot (Nitrogenium) | N |
| 8 | Oksijen | O |
| 9 | Flor | F |
| 10 | Neon | Ne |
| 11 | Sodyum (Natrium) | Na |
| 12 | Magnezyum | Mg |
| 13 | Alüminyum | Al |
| 14 | Silisyum | Si |
| 15 | Fosfor (Phosphoros) | P |
| 16 | Kükürt (Sulphurium) | S |
| 17 | Klor | Cl |
| 18 | Argon | Ar |
Bileşikler, İyonlar
Bileşikler formüllerle gösterilir. Bileşiğin formülünü yazarken bileşiği oluşturan en küçük birimin içerdiği elementlerin sembolleri ve atom sayısı belirtilir.


Bileşiklerin formüllerine bakılarak moleküllerin hangi elementlerden oluştuğu ve toplam kaç atom içerdiği söylenebilir.

| No | Elementin Adı | Sembol |
| 24 | Krom (Chrome) | Cr |
| 26 | Demir (Ferrum) | Fe |
| 28 | Nikel (Niccolum) | Ni |
| 29 | Bakır (Cuprum) | Cu |
| 30 | Çinko (Zincum) | Zn |
| 47 | Gümüş (Argentum) | Ag |
| 50 | Kalay (Stannum) | Sn |
| 53 | İyot (Iodium) | I |
| 79 | Altın (Aurum) | Au |
| 80 | Civa (Hydrargyrum) | Hg |
| 82 | Kurşun (Plumbum) | Pb |
| Adı | Formülü | Modeli | Kullanım |
| Su | H2O |  |
Temel ihtiyaç maddesidir |
| Amonyak | NH3 | 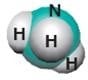 |
Temizlik malzemeleri, patlayıcı ve
gübre yapımı |
| Karbondioksit | CO2 | Yangın
söndürme tüpüve gazlı içeceklerde |
|
| Kükürtdioksit | SO2 | Şeker
üretiminde |
|
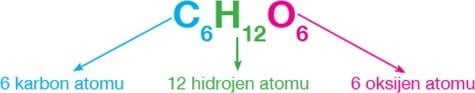
| Basit Şeker | C6H12O6 | Temel besin maddesidir. | |
| Hidrojen klorür | HCl | Temizlik malzemeleri nde | |
| Sodyum klorür | NaCl | Sofra tuzu | |
| Kalsiyum oksit | CaO | 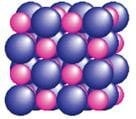 |
Kireç taşı ve mermerde
bulunur. |
| Sodyum iyodür | NaI |  |
Tıpta
hastalık teşhis ve tedavisinde |
KARIŞIMLAR
-
- Karışımlar
İki ya da daha fazla maddenin rastgele oranlarda bir araya gelmesine karışım denir. Karışımlar saf madde değildir ve yeni madde oluşmaz.
- Birden çok element ya da bileşikten oluşur.
- Kendini oluşturan maddeler kendi özelliklerini kaybetmezler
- Fiziksel yöntemlerle kendini oluşturan maddelere ayrılabilirler.
- Homojen ya da heterojen olabilirler.
- Sembol ya da formülleri yoktur.
Karışımlar görünümleri bakımından ikiye ayrılırlar:
Karışımlar
Heterojen Karışımlar
Homojen Karışımlar
Karışımı oluşturan maddeler karışımın her tarafına eşit miktarlarda dağılmıyorsa bu tür karışımlara heterojen karışım adı
verilir. Adi karışımlar bir tür heterojen karışımdır. Örneğin zeytinyağlı su, talaşlı su, kumlu su vb.
Karışımı oluşturan maddeler karışımın her tarafına eşit olarak dağılmışsa bu tür karışımlara homojen karışım denir.
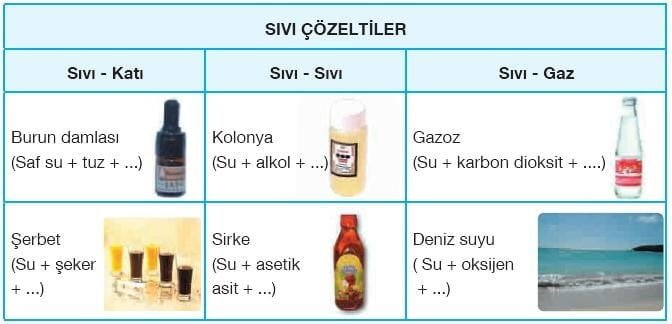
Homojen karışımlara çözelti adı verilir. Örneğin şekerli su, tuzlu su vb.
Çözeltileri oluşturan maddelerden miktarı çok olan çözücü, az olan da çözünen olarak adlandırılır. Fakat sulu çözeltilerde suyun miktarı az bile olsa su çözücü olarak kabul edilmektedir.
Soluduğumuz hava, içerisinde bazı canlıların yaşadığı sular, içtiğimiz meşrubatlar, diş dolgusunda kullanılan amalgamlar, kullandığımız metal paralar, hepsi birer çözeltidir. Çözeltiler fiziksel hâllerine bağlı olarak katı, sıvı veya gaz hâlde bulunur.
 Çözelti oluşurken çözücü ve çözünen maddeler arasında bir etkileşim olur.
Çözelti oluşurken çözücü ve çözünen maddeler arasında bir etkileşim olur.
Çözünen maddenin tanecikleri çözücü ile etkileşerek birbirinden ayrılır ve çözücünün her tarafına dağılır. Bu dağılma sırasında çözücünün tanecikleri çözünenin taneciklerinin etrafını sarar.
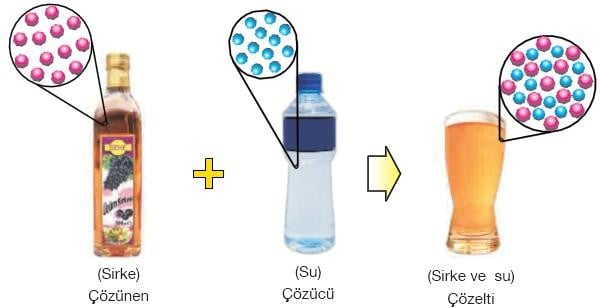
Çözünme, çözücü ve çözünen maddelerin birbiri içinde iyonlarına veya moleküllerine ayrılmasıdır.
Çözündüğü zaman iyonlarına ayrılan iyonik bileşikler elektriği iletirler. Bu çözeltilere elektrolit çözeltiler denir. Çözündüğü zaman moleküllerine ayrılan moleküler bileşikler ise elektriği iletmezler. Elektriği iletmeyen bu çözeltilere elektrolit olmayan çözelti denir.
Çözünme Hızına Etki Eden Faktörler: 1.Sıcaklık: Sıcaklık arttıkça çözünme hızlanır.
- Temas yüzeyi (Tanecik boyutunu küçültme): Temas yüzeyi arttıkça çözünme hızlanır. Toz şeker küp şekerden daha hızlı çözünür.
- Karıştırma: Karıştırma işlemi çözücü taneciklerin çözünen taneciklerin etrafını daha hızlı sarmasını sağlar, yani çözünme hızlanır.
Karışımların Ayrıştırılması
Buharlaştırma: Su ve suda çözünmüş katı maddelerden oluşan bazı karışımları ayırmak için kullanılır. Bu yöntemde su ısıtılarak buharlaştırılır ve geriye suda çözünen katı madde kalır. Su da tekrar yoğuşturularak ayrı bir kapta toplanabilir.
Tuzlu suyun ayrıştırılmasında bu yöntemden faydalanılır.
Damıtma: Sıvı – sıvı karışımlar sıvıların kaynama sıcaklıkları farkından yararlanarak ayrıştırılabilir.
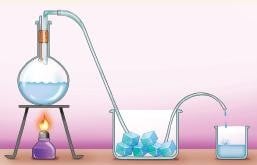
Bu yöntemde sıvılar ısıtılır. Kaynama noktası daha düşük olan sıvı buharlaşır ve soğutucu bölümden geçerken tekrar yoğuşarak diğer kapta toplanır. Isıtılan kapta ise kaynama noktası yüksek olan sıvı kalır. Etil alkol-su karışımı bu şekilde ayrıştırılabilir.
Yoğunluk farkından yararlanma:
Yoğunlukları birbirinden farklı olan katı-katı ve sıvı-sıvı karışımlar bu şekilde ayrıştırılabilir.
Yoğunlukları farklı olan katı maddeler su dolu kaba atılır. Suda yüzen maddeler bir kaşık yardımıyla alınırken, suya batan madde ise kapta kalır. Bu yöntem
yüzdürme yöntemiyle ayırma olarak da bilinir. Talaş-kum karışımı bu şekilde ayrıştırılabilir.

Yoğunlukları farklı olan sıvı maddeler ayrıma hunisi yardımıyla ayrıştırılırlar.
Yoğunlukları farklı olan sıvılar ayırma hunisine konulur. Yoğunluğu büyük olan sıvı altta, küçük olan ise üstte kalır. Musluk açılarak yoğunluğu fazla olan sıvının başka bir kaba alınması sağlanır. Yoğunluğu büyük olan sıvı tamamen alındığında musluk kapatılır.
EVSEL ATIKLAR ve GERİ DÜNÜŞÜM
– KİMYA ENDÜSTRİSİ
-
- Evsel Atıklar
Geri dönüşüm, kullanım dışı kalan geri dönüştürülebilen atık malzemelerin çeşitli geri dönüşüm yöntemleri ile ham madde hâlinde tekrar imalat sürecine kazandırılmasıdır.

Kâğıt, cam şişeler, plastik şişeler, metal içecek kutuları, demir, çelik, bakır, alüminyum, araç lastikleri, elektronik atıklar, atık yağlar, akümülatörler gibi maddeler geri dönüştürülebilen katı atıklardır.
Kanalizasyon suları da artıma tesislerinde çeşitli işlemlerden geçerek tekrarkullanılabilir hale gelen sıvı atıktır. Kızartma yağı gibi sıvı atıklar ise geri dönüştürülemezler.

Doğal kaynaklarımız, dünya nüfusunun artması ve tüketim alışkanlıklarının değişmesi nedeni ile her geçen gün azalmaktadır. Bu nedenle malzeme tüketimini azaltmak, değerlendirilebilir nite- likli atıkları geri dönüştürmek sureti ile doğal kaynakların verimli olarak kullanılması gerekmektedir.
Geri dönüşüm, uzun vadede verimli bir ekonomik yatırımdır. Ham maddenin azalması ve doğal kaynakların hızla tükenmesi sonucunda ekonomik problemler ortaya çıkabilmektedir.
Geri dönüşümün bu noktada ekonomi üzerinde olumlu etkileri olabilmektedir.
Enerji ve doğal kaynakların tüketiminin azaltılması ülke ekonomisi için önemlidir. Geri dönüşümle, geri dönüşüm tesislerinde üretilen sentetik elyaf gibi ürünler yurt dışına satılarak ülke ekonomisine katkı sağlanmış olur. Ayrıca geri dönüşüm için kurulan tesisler insanlara da iş imkânı sağlar. Meslek sahibi olan insanlar hem aile ekonomilerine hem de ülke ekonomilerine katkıda bulunmuş olurlar.
Kimya Endüstrisi
Kimya endüstrisi ürünleri hayatımızın vazgeçilmez parçalarındandır. Temizlik malzemelerinden gıda maddelerine, kozmetikten, ilaç bilimine, tekstilden, yapı malzemelerine, gübreden patlayıcı maddeye, boyadan, laboratuar kimyasallarına kadar birçok ürün ya doğrudan kimya fabrikalarında üretilmekte ya da ham maddeleri kimya fabrikalarından sağlanmaktadır.

Kimya sektörü endüstrinin temel taşı niteliğindedir. Neredeyse üretilen her ürünün ham maddesini kimya sektörü sağlamaktadır. Otomotiv, deri ürünleri, cam, tekstil ve kâğıt türleri gibi sektörler kimya sektörü ile iç içe çalışmaktadır.
Kimya endüstrisi, ülkelerin gelişmişlik düzeyleriyle doğru orantılı olarak üretimi ve tüketimi artan bir endüstri koludur.
Kimya endüstrisi ürünlerinin üretilmesi İçin fabrikalara, işletmelere ihtiyaç vardır.

Ülkemizde Makine ve Kimya Endüstrisi Kurumu, kimya endüstrisi alanındaki resmî kurumdur. Bu kurumun savunma sanayi alanında birçok fabrikası bulunmaktadır.
Bunun yanında TÜBİTAK ve üniversiteler de yaptıkları bilimsel çalışmalarla kimya sektörüne katkı sağlamaktadır.

Ülkemizde Türkiye Kimya Sanayicileri Derneği gibi sivil toplum kuruluşları da bulunmaktadır. Bu derneğin, kimya endüstrisine katkı sağlayan sektörlerin genel ve güncel sorunlarını, resmi kurumlarla çözmek, sivil toplum kuruluşlarıyla iş birliği yapmak gibi faaliyetleri vardır.

